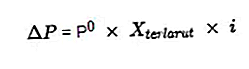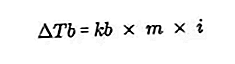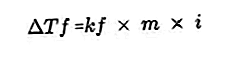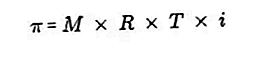우리 주변의 화학과 관련된 것에주의를 기울이려고합니까? 가장 쉬운 것은 산소, 질소 및 기타 가스의 혼합물을 포함하는 우리가 호흡하는 공기입니다. 식용 조미료, 식용 색소, 식품 방부제는 우리 주변에있는 화학 물질의 또 다른 예입니다. 화학은 다양한 재료를 연구하는 학교에서 공부하게 될 자연 과학의 한 분야입니다. 한 가지 예는 물질의 구조, 물질의 특성, 물질 형태, 물질의 변화, 물질의 분류, 물질의 배열과 이에 수반되는 에너지입니다. 변화. 수학과 물리학뿐만 아니라 화학에도 다양한 종류의 공식이 있습니다. colligative 속성에서 산화 환원 반응에 이르기까지 배울 수있는 많은 화학 공식이 있습니다.
이 기회에 우리는 화학 공식의 개념을 이해하는 데 도움이 될 다양한 화학식과 그 문제의 예를 배울 것입니다.
화학식 및 예제 문제
화학에서 공식의 존재는 연구자들이 수행 할 다양한 종류의 실험 결과를 찾도록 돕는 것입니다. 이 과학을 잘 습득하려면 화학을 공부할 때 자주 접하게되는 몇 가지 화학식을 알아야합니다.
솔루션의 총괄 속성 공식
용액의 충돌 특성은 용해성 물질의 유형에 의존하지 않고 용액 입자의 농도에만 의존하는 용액의 특성입니다. 그런 다음 용액의 결합 특성은 두 가지 유형의 특성, 즉 전해질 용액의 결합 특성과 비 전해질 용액의 결합 특성으로 구성됩니다.
- 비 전해질 용액의 총괄적 특성
colligative 성격은 용액을 포함하지만 colligative 성격은 용질과 용질 분자의 상호 작용에 의존하지 않고 용액에 용해 된 용질의 양에 의존합니다. 충돌 특성은 증기압 감소, 끓는점 증가, 빙점 감소 및 삼투압으로 구성됩니다. 각각은 결과를 얻기 위해 화학 공식이 필요합니다.
- 증기 압력 강하 방정식

출처 : formula.co.id
- 끓는점 증가 방정식
액체의 끓는점은 끓는 고정 온도입니다. 이 온도에서 액체의 증기압은 주변의 공기압에 대한 방정식을 가지며 액체의 모든 부분이 증발하여 발생합니다. 액체의 끓는점은 1 기압의 압력으로 측정 할 수 있습니다.
용액의 끓는점과 순수한 용매의 끓는점의 차이를 끓는점 증가라고하며 끓는점 증가 방정식은 다음과 같습니다.

출처 : formula.co.id
- 어는점 강하 방정식
용액에 존재하는 용질은 용액의 빙점을 용매의 빙점보다 작게 만듭니다. 어는점 감소 방정식 :

출처 : formula.co.id
- 삼투압
삼투압은 용액을 통해 반투막에서 용매의 압력 균형을 맞추는 데 필요한 힘입니다.
반투막은 용매 분자는 통과 할 수 있지만 용질은 통과 할 수없는 막입니다. Van't Hoff에 따르면 삼투압에서 용액은 다음과 같이 공식화됩니다.

출처 : formula.co.id
- 전해질 용액의 총괄적 특성
동일한 전해질 용액의 응집 특성의 농도에서 비 전해질 용액의 응집 특성과 비교할 때 더 큰 값을 갖습니다. Van't Hoff 인자로 공식화 된 전해질 용액의 이온화 반응으로 인해 발생하는 많은 수의 용질 입자 때문입니다.
전해질 용액의 충돌 특성 계산에는 항상 다음과 같이 Van't Hoff 계수가 곱해집니다.

출처 : formula.co.id
다른 전해질 용액의 Colligative 특성에 대한 몇 가지 공식은 다음과 같습니다.
- 증기압 강하
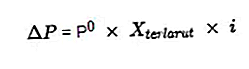
출처 : formula.co.id
- 끓는점 증가
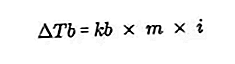
출처 : formula.co.id
- 어는점 하락
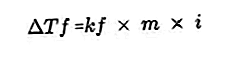
출처 : formula.co.id
- 삼투압
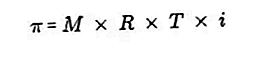
출처 : formula.co.id
몰 농도, 몰랄 농도 및 몰 분율 공식
몰 농도 (M)
몰 농도는 1 리터의 용액에 용해 된 물질의 몰수입니다.

출처 : formula.co.id
M = 몰 농도
Mr = 용질의 몰 질량 (g / mol)
V = 용액 부피
Molality (m)
Molality는 1kg의 용매에 용해 된 물질의 몰수입니다. 화학식은 다음과 같습니다.

출처 : formula.co.id
m = 몰 랄리 티 (mol / kg)
Mr = 용질의 몰 질량 (g / mol)
질량 = 용질의 질량 (g)
P = 용매의 질량 (g)
몰 분획
몰 분율은 용액의 모든 성분이 몰을 기준으로 계산되는 농도 단위입니다.

출처 : formula.co.id
xi = 두더지 수
나는, j, xj = 몰분율
화학식 문제의 예
1. 32 ° C에서 500ml의 과당 용액, C6H12O6의 삼투압이 2 기압이면 용해 된 과당의 질량은?
해결책:

2. 물에있는 요소 용액의 몰 분율 0.2. 온도가 20 ° C 인 순수한 물의 포화 증기압은 17.5 mmHg입니다. 다음 온도에서 용액의 포화 증기압에서?
엑스요소 + X물 = 1
0.2 + X물 = 1
엑스물 = 0,8
피해결책 = X물 x P 물
피해결책 = 0.8 x 17.5 mmHg
피해결책 = 14mmHg
이것들은 다양한 종류의 화학 질문에 더 쉽게 답할 수 있도록 배울 수있는 몇 가지 화학 공식입니다. 이러한 공식이 충분하지 않다고 생각되면 Trigonometry, Limit, Logarithm 등과 같은 Smart Class에서 질문을 연습 할 수있는 가중되고 완전한 온라인 솔루션 인 PROBLEM 제품을 사용해 볼 수 있습니다. 수학, 물리, 화학 등 다양한 과목으로 초, 중, 고등학교 수준. 여기에서는 예제 문제로 완성 된 다양한 종류의 공식을 배울 수 있습니다.
어서, 당신은 무엇을 기다리고 있는가! 지금 바로 Smart Class에서 문제 연습을 해보겠습니다.